Oavsett om du är positivt eller negativt inställd till fett som del i mat eller kropp så är det en fördel att känna till den kemiska bakgrunden.
”Jag hatar kemi, värsta ämnet i skolan!”
Helt säkert är det onödigt många som tycker så eller åtminstone något liknande. Då är det definitivt dags att tänka om, särskilt om du vill göra något åt en övervikt. Kroppen ”vet” definitivt allt om sin fettkemi, den tillverkar och lagrar ur det du äter. Kan du tillåta att kroppen är så överlägsen din hjärna?
Om du tar till dig eller själv använder påståenden som ”undvik mättade fetter, de är farliga” och ”ät mer fleromättade fetter, de är jättenyttiga” så är jag övertygad om att du kan vidga dina perspektiv avsevärt. Det sker inte i en handvändning, därför blir det flera inlägg.
Grundläggande kemi om vårt garanterat största energilager
Endast tre grundämnen bygger samtliga fettsyror, nämligen väte, syre och kol. De kan binda till många andra ämnen, men i detta sammanhang fokuserar jag enbart på deras inbördes umgänge.
Kemister talar om bindningar mellan atomer, de kan ha flera betydelser som jag inte går närmare in på. Betrakta dem för enkelhets skull som utsträckta händer, beredda att ta andra i hand. Snart nog slutar jag att referera till ”händer” och ”greppa” och övergår till det mer traditionell ”binda” och ”bindningar”.
- Väteatomen (H) kan ”hålla sin enda hand” med andra väteatomer (blir vätgas, H2) men även med kol och syre (t.ex. en syre + två väte, H2O = vatten).
- Syreatomen (O) har två ”händer”. När syre ”håller varandra med båda händer” bildas syrgas (molekylen O2). När syre reagerar med kol i metabolismen (ämnesomsättningen) ger det koldioxid (CO2). Det krävs två syreatomer med vardera två ”händer” för att ”greppa” de fyra som en ensam kolatom har.
- Kolatomer (C) är unika då de kan bilda kedjor. En kolatom är ”fyrhänt” och kan ”hålla hand” med upp till 4 atomer samtidigt. Inte så sällan greppar två kolatomer varandra med dubbelfattning, en dubbelbindning. Självklart blir det då färre händer/bindningar över till annat. En dubbelbindning är dessutom ”stelare” än en enkel bindning, testa gärna skillnaden genom att hålla en annan person med två händer istället för en.
Kolkedjan
 Den enklaste varianten är en rad kolatomer med enkelbindningar emellan och varje kol dessutom binder till två väteatomer. Här är alla atomer angivna med bokstäver och de linjer som slutar i tomma intet antyder att kedjan ansluter till något annat.
Den enklaste varianten är en rad kolatomer med enkelbindningar emellan och varje kol dessutom binder till två väteatomer. Här är alla atomer angivna med bokstäver och de linjer som slutar i tomma intet antyder att kedjan ansluter till något annat.

Det finns andra sätt att illustrera kolkedjor, till vänster finns kolen där linjerna korsar varandra och där linjerna slutar finns alltid en väteatom. Denna är C3H8, propangas.

Ytterligare ett sätt med annorlunda regler. Här finns det en kolatom vid varje ände av strecken, dessutom en i varje knick, sammanlagt 6 st. En tilläggsregel är att kolatomerna binder till 4 andra atomer om inget annat anges. Kolen i de 4 knickarna har underförstått 2 väteatomer vardera och i ändarna finns det 3 väte, alltså C6H14, hexan, en komponent i bensin.
Metyländen
 En kolatom har 4 möjliga ”händer” och om vardera greppar var sin väte bildas gasen metan (CH4).
En kolatom har 4 möjliga ”händer” och om vardera greppar var sin väte bildas gasen metan (CH4).
 När en kolatom binder tre väte kallas det en metylgrupp (CH3–) Minustecknet betyder att gruppen som helhet har ett elektronöverskott, men kan även betraktas som att den har ”en hand över” som kan binda till något annat. Den finns inte som en fristående molekyl utan alltid som en del i ett annat ämne. En metylgrupp kan kemiskt betraktas som ett ordnat avslut på en kolkedja. Metyländen avslutar den feta delen av en fettsyra och kallas även omega-änden, mer om detta senare.
När en kolatom binder tre väte kallas det en metylgrupp (CH3–) Minustecknet betyder att gruppen som helhet har ett elektronöverskott, men kan även betraktas som att den har ”en hand över” som kan binda till något annat. Den finns inte som en fristående molekyl utan alltid som en del i ett annat ämne. En metylgrupp kan kemiskt betraktas som ett ordnat avslut på en kolkedja. Metyländen avslutar den feta delen av en fettsyra och kallas även omega-änden, mer om detta senare.
Karboxyländen
 Detta är den andra änden av en fettsyra, det flertalet kemister betraktar som början, alfaänden. Alfa är den första bokstaven i det grekiska alfabetet, de följande kolatomerna kan numreras men vid namngivning används gärna det grekiska alfabetet. Skrivet på ett mycket kompakt men oöverskådligt sätt: COOH– Det är heller inte en fullständig molekyl, den har ett elektronöverskott och därmed en ”ledig hand” där den binder till resten av kolkedjan i en fettsyra. Mycket generellt kan det skrivas R-COOH där R** kan tolkas som ”Resten av molekylen”
Detta är den andra änden av en fettsyra, det flertalet kemister betraktar som början, alfaänden. Alfa är den första bokstaven i det grekiska alfabetet, de följande kolatomerna kan numreras men vid namngivning används gärna det grekiska alfabetet. Skrivet på ett mycket kompakt men oöverskådligt sätt: COOH– Det är heller inte en fullständig molekyl, den har ett elektronöverskott och därmed en ”ledig hand” där den binder till resten av kolkedjan i en fettsyra. Mycket generellt kan det skrivas R-COOH där R** kan tolkas som ”Resten av molekylen”
Karboxyländen kan koppla vidare till andra molekyler, dess OH-grupp (hydroxylgrupp) har den förmågan.
- OH-grupper i molekyler ”umgås” gärna med vatten och är de tillräckligt många i förhållande till molekylen i övrigt så kan molekylen som helhet transporteras i blodet utan hjälp.
- Finns rätt enzymer tillgängliga när två lämpliga molekyler med OH-grupper på rätt ställen träffs så drar enzymet de två molekylerna intill varandra, i skarven plockar det bort två väte och ett syre (som bildar vatten), kvar återstår en syreatom som fungerar som ”koppel”. Processen kallas förestring.
- Om det går åt andra hållet, ett annat enzym försedd med en vattenmolekyl kommer till samma bindning så kan den ”peta in” den i bindningen så den faller isär, hydrolyseras***
Fettsyra
 När man kopplar samman en metylände med en kolkedja och en karboxylände blir slutresultatet en fettsyra som får sitt grundläggande namn av antal kol i hela molekylen. Den till vänster heter butansyra, även känd som smörsyra. Väteatomen, H i karboxylgruppens OH sitter lite ”halvlöst” och under vissa omständigheter lossnar den och bildar en H+-jon (egentligen en hydroniumjon, H3O+), just det som kännetecknar en syra, se där skälet till att det heter fettsyra. Alla organiska syror räknas som svaga även om det finns några med få kolatomer som överraskar.
När man kopplar samman en metylände med en kolkedja och en karboxylände blir slutresultatet en fettsyra som får sitt grundläggande namn av antal kol i hela molekylen. Den till vänster heter butansyra, även känd som smörsyra. Väteatomen, H i karboxylgruppens OH sitter lite ”halvlöst” och under vissa omständigheter lossnar den och bildar en H+-jon (egentligen en hydroniumjon, H3O+), just det som kännetecknar en syra, se där skälet till att det heter fettsyra. Alla organiska syror räknas som svaga även om det finns några med få kolatomer som överraskar.
Grattis, redan nu vet du långt mer om fettsyror än de flesta, men vi stannar inte där, fortsättning följer.
*) Du kanske har hört talas om metylering, ” kemiska” för att ”sätta punkt” i t.ex. en kolkedja eller DNA.
**) En del molekylgrupper kan koppla upp sig åt mer än ett håll och därför ser man förutom R även R’
***) Hydrolysera: Hydro står för vatten och lysera för att upplösa, sära på.
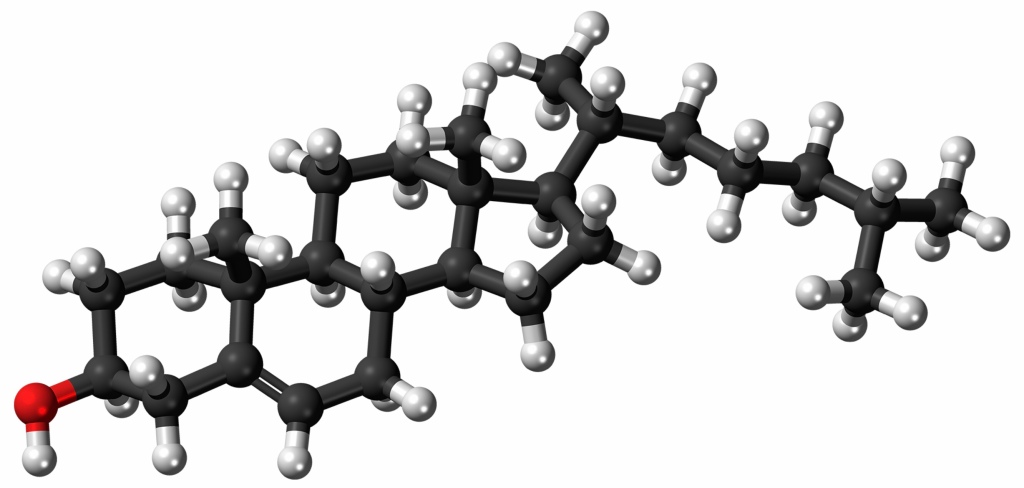














 När en kolatom binder tre väte kallas det en metylgrupp (CH3–) Minustecknet betyder att gruppen som helhet har ett elektronöverskott, men kan även betraktas som att den har ”en hand över” som kan binda till något annat. Den finns inte som en fristående molekyl utan alltid som en del i ett annat ämne. En metylgrupp kan kemiskt betraktas som ett ordnat avslut på en kolkedja. Metyländen avslutar den feta delen av en fettsyra och kallas även omega-änden, mer om detta senare.
När en kolatom binder tre väte kallas det en metylgrupp (CH3–) Minustecknet betyder att gruppen som helhet har ett elektronöverskott, men kan även betraktas som att den har ”en hand över” som kan binda till något annat. Den finns inte som en fristående molekyl utan alltid som en del i ett annat ämne. En metylgrupp kan kemiskt betraktas som ett ordnat avslut på en kolkedja. Metyländen avslutar den feta delen av en fettsyra och kallas även omega-änden, mer om detta senare. Detta är den andra änden av en fettsyra, det flertalet kemister betraktar som början, alfaänden. Alfa är den första bokstaven i det grekiska alfabetet, de följande kolatomerna kan numreras men vid namngivning används gärna det grekiska alfabetet. Skrivet på ett mycket kompakt men oöverskådligt sätt: COOH– Det är heller inte en fullständig molekyl, den har ett elektronöverskott och därmed en ”ledig hand” där den binder till resten av kolkedjan i en fettsyra. Mycket generellt kan det skrivas R-COOH där R** kan tolkas som ”Resten av molekylen”
Detta är den andra änden av en fettsyra, det flertalet kemister betraktar som början, alfaänden. Alfa är den första bokstaven i det grekiska alfabetet, de följande kolatomerna kan numreras men vid namngivning används gärna det grekiska alfabetet. Skrivet på ett mycket kompakt men oöverskådligt sätt: COOH– Det är heller inte en fullständig molekyl, den har ett elektronöverskott och därmed en ”ledig hand” där den binder till resten av kolkedjan i en fettsyra. Mycket generellt kan det skrivas R-COOH där R** kan tolkas som ”Resten av molekylen”